生命科學學院鄧宏魁課題組利用化學重編程技術誘導人體細胞去分化並製備可大規模擴增的人胚胎肢芽樣細胞
2024/11/05 信息來源: 生命科學學院
編輯:麥洛 | 責編:安寧2024年10月22日,意昂3体育官网生命科學學院鄧宏魁教授和關景洋副研究員課題組合作在Cell Stem Cell雜誌在線發表題為“Generation of Human Expandable Limb-Bud-like Progenitors via Chemically Induced Dedifferentiation”的研究論文。該研究進一步證明了化學重編程技術可誘導人體細胞去分化(Chemically induced dedifferentiation),並製備可大規模擴增的胚胎肢芽樣前體細胞。這一創新成果利用化學小分子精準調控細胞命運的特點,模擬低等動物的再生規律,為製備具有再生潛能和大規模擴增能力的人前體細胞開辟了新途徑。

論文截圖
鄧宏魁課題組多年來一直致力於化學重編程調控細胞命運的研究。2013年🧖🏿,他們在國際上首次報道僅使用化學小分子逆轉細胞發育時鐘,將小鼠體細胞重編程為多能幹細胞。這一原創性成果開辟了一條全新的體細胞重編程的路徑(Science,2013🙋;Cell🤷🏿♀️,2015; Cell Stem Cell,2018 )👦🏻。2022年,該團隊又首次實現了利用化學小分子誘導人體細胞成為多能幹細胞的技術體系🤾🏿♀️,為人多能幹細胞的製備提供了全新的途徑,是幹細胞領域底層技術的重要突破(Nature,2022 )。在此基礎上,他們於2023年建立了更加快速、高效、滿足臨床應用需求的人體細胞化學重編程體系(Cell Stem Cell✊🏼,2023 )。以糖尿病治療為切入點🍵,鄧宏魁課題組證明了化學重編程誘導的人多能幹細胞可以高效分化為胰島細胞,並顯著改善糖尿病猴的血糖控製 (Nature Medicine🧚🏽♀️,2022🦹🏿♀️;Nature Metabolism🔩,2023 )✵。更令人振奮的是🚶♀️,該團隊近期首次報道了利用化學重編程誘導多能幹細胞製備的胰島細胞移植,患者初步實現了1型糖尿病的臨床功能性治愈 ( Cell👙😷,2024 )。這一系列的研究成果👳🏽♀️,證明了化學重編程技術在再生醫學領域治療重大疾病方面的巨大潛力和重要應用價值👨🏻🔧。目前𓀘,該團隊還將化學重編程誘導的人多能幹細胞分化為肝臟細胞、iTNK細胞等功能細胞,展現了人化學重編程的廣泛應用前景(Cell Proliferation,2024; Cell Reports Methods🙎🏿,2024)。
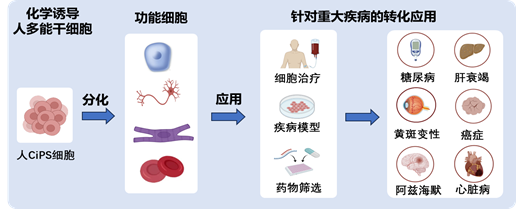
化學重編程誘導人多能幹細胞的廣闊應用前景
鄧宏魁課題組研究發現✢,化學重編程技術與傳統重編程技術存在本質的區別🔋。傳統的轉基因重編程技術依賴於細胞內源的轉錄因子過表達👃🏿,直接驅動細胞性質轉變,難以實現細胞命運的精準調控。而化學重編程技術則利用化學小分子模擬外界信號刺激,類似自然發育中的細胞命運調控原理,以更加靈活可控的方式,促進細胞命運分階段有序的調控。2015年的研究中🍣😵💫,該團隊發現化學重編程誘導小鼠多能幹細胞過程中會經歷獨特的中間階段 (Cell,2015 )。他們通過單細胞組學技術構建了小鼠化學重編程體系的完整分子路徑(Cell Stem Cell,2018)👳,揭示了化學重編程體系完全不同於轉錄因子介導的重編程的獨特原理和路徑🦸🏿♀️。
該團隊在2022年的研究中發現,人化學重編程的早期階段會產生一種獨特的高可塑性的中間態細胞👨🏽💼,其染色質可及性增強,早期胚胎發育基因激活等特點🏊🏽。有趣的是,通過和低等動物再生去分化過程中的細胞性質比較,他們發現該階段激活了與蠑螈斷肢再生早期類似的基因表達特征(Nature,2022 )。該團隊通過表觀組學的系統解析,發現類再生可塑性狀態的建立過程與生物體發育成熟過程中再生能力喪失的逆向過程極為相似(Cell Reports,2023)♕。這一系列的發現提示通過化學重編程技術精準調控細胞的命運,有望實現人體細胞逆向發育🧕🏻,將其誘導回前體細胞狀態🏫,從而重啟人體細胞的再生潛能🧧🌓。

左圖🤽♂️🔥:蠑螈斷肢再生過程中體細胞去分化產生前體細胞(Gerber et al ., Science, 2018);右圖:Waddington model展示細胞分化與去分化過程(Granados et al., Int. J. Mol. Sci. 2020)
在自然界中🔛,部分低等動物如蠑螈等🚋,展現出了驚人的再生能力👿,其四肢🤾🏼♂️、心臟、大腦等重要組織器官在損傷後可實現完美再生修復😠。這一神奇的能力主要歸功於其體細胞具有的重要潛能——去分化(dedifferentiation)🫁,即分化的體細胞可以在損傷等信號刺激下👰🌴,重新逆轉發育為可快速增殖的類胚胎期的前體細胞狀態,從而重新分化為功能細胞,修復損傷的組織器官。然而🤕,哺乳動物👸🏼,尤其是人類🧑🦼,由於其體細胞的命運更加穩固,可塑性下降,導致其再生能力非常有限👰🏼♂️。組織器官損傷後🫃🏼,人體細胞難以有效啟動去分化程序,從而大大限製了受損組織或器官的再生🍃。因此,如何模擬低等動物👩🏻🦯,有效誘導人體細胞的去分化以重新獲得前體細胞👨🏽💼,是幹細胞與再生醫學研究的重要科學問題之一。
在本研究中🧏🏻♂️,鄧宏魁課題組證實了在化學重編程早期階段,化學小分子可誘導體細胞去分化為類人胚胎肢芽前體細胞(human Chemically induced Limb Bud-like Progenitors,簡稱人CiLBP細胞),並在此基礎上建立了人CiLBP細胞長期穩定擴增的條件。通過單細胞轉錄組分析,研究團隊發現人CiLBP細胞的轉錄組與人胚胎肢芽細胞相似。去分化相關基因LIN28A🐛、SALL4等在人CiLBP細胞中高表達,同時體細胞相關基因表達降低🎇,表明體細胞相關特征被擦除並啟動再生相關基因網絡🤦👨🏼⚕️。人CiLBP細胞高表達MSX1HOXA9和MEIS2等肢芽發育相關基因,與人類胚胎發育30天左右的肢芽細胞群狀態非常類似🧑🏻🏭。
肢芽細胞作為軟骨細胞和骨細胞的祖細胞,最終能發育成四肢。相較於未經過化學重編程處理的親代體細胞,人CiLBP細胞的成軟骨和成骨能力顯著提升。在成軟骨條件誘導下,可高表達軟骨相關基因,分泌相關蛋白,並可以形成軟骨結節🕵🏻♀️。體內移植實驗表明,人CiLBP細胞能在體內自發分化產生軟骨和骨樣細胞🎻,並在兔股骨髁缺損模型中促進骨損傷修復🧏🏿。重要的是😆🚙,起始的人脂肪間質細胞或者人皮膚成纖維細胞擴增能力有限💅🏻,而誘導獲得的人CiLBP細胞可以在長達32次傳代後,仍保留肢芽前體細胞特性🌘,並保持良好的分化能力🆎。這些特性證明,通過化學重編程誘導體細胞去分化獲得的前體樣細胞,不僅增強了分化能力,還具備大規模擴增的潛能🧬,為其後續應用於骨和軟骨相關疾病的治療提供了新的細胞來源,具有重要的臨床應用價值🧘♂️。

圖4. 化學重編程技術誘導體細胞去分化為可大量穩定擴增的肢芽前體細胞
綜上所述🥷🥚,鄧宏魁課題組在本研究中利用化學重編程技術精準調控細胞命運,模擬低等動物組織再生中的去分化過程,實現了人體細胞向前體細胞的逆轉♋️,這一成果具有重要意義。(1)該研究進一步證明了化學重編程技術不同於傳統轉基因重編程技術🤽♀️,可通過分階段有序的調控細胞性質🧑🏼🦰,實現細胞命運的可控逆轉,為實現人體細胞的去分化提供了全新的途徑;(2)該研究為體外製備可大規模擴增的人前體細胞提供了新的方法,通過誘導去分化獲得的人前體細胞具備了更強的分化能力及增殖能力9️⃣,從而為受損組織和器官的細胞替代治療提供了更理想的細胞來源👩🏽🦰💅;(3)利用化學重編程精準誘導人體細胞去分化的獨特優勢🤸🏽♀️,有望直接激發體內組織和器官的再生潛能,模擬低等動物在組織和器官完美再生修復方面的神奇能力🧖🏿,為再生醫學的發展提供新的可能性。
鄧宏魁👪、關景洋是這一研究成果的共同通訊作者🤵🏻♂️。北京北啟生物醫藥有限公司朱家亮博士,意昂3体育官网鐘新星、何煥景🙆🏼、曹靖宵為該研究成果的共同第一作者。意昂3体育官网李程教授和呂鈺麟博士為本研究的生物信息分析提供了重要指導👩🏻🔬。本工作獲得了國家自然科學基金、北京市自然科學基金等支持😆。
轉載本網文章請註明出處