生命科學學院杜鵬課題組利用全能性幹細胞實現小鼠早期胚胎發育過程精準重建
2025/02/03 信息來源: 生命科學學院
編輯🚶🏻♀️➡️:麥洛 | 責編🦹🏽♂️:燕元早期胚胎發育是生命科學領域的核心研究方向之一。胚胎從受精卵開始發育,經過基因組激活(zygotic genome activation, ZGA)、快速細胞分裂和譜系分化,最終形成囊胚🕒,為胚胎著床及後續發育奠定基礎。在這一過程中👨🏽🏫🎾,囊胚內三譜系的形成——內細胞團(inner cell mass, ICM)、原始內胚層(primitive endoderm, PrE)和滋養外胚層(trophectoderm, TE)——標誌著胚胎命運決定的關鍵轉折點。然而,受限於胚胎樣本的稀缺性和實驗條件的限製💂🏻♂️👩❤️💋👩,如何構建精準模擬早期胚胎發育的體外系統✍🏻,仍是該領域亟待解決的科學難題。
2021年👷🏽♀️,意昂3体育官网生命科學學院杜鵬教授課題組通過抑製剪接體,首次捕獲並穩定培養了小鼠全能性幹細胞(mouse totipotent blastomere-like cells, mTBLCs)(Shen et al., 2021)。與經典的多能性幹細胞不同🙆🏼♀️,mTBLCs能夠重現全能性卵裂球的特征,為構建從單細胞開始的分化和囊胚形成模型提供了理想的“種子細胞”。 2024年🚣🏼♀️𓀁,研究團隊利用相同的策略獲得了人的全能性幹細胞(Li et al., 2024),為進一步探索全能性及其在胚胎發育研究中的應用提供了重要工具。
基於mTBLCs的這一特性,2025年1月17日,杜鵬課題組在Cell Stem Cell雜誌在線發表了題為“Mouse totipotent blastomere-like cells model embryogenesis from zygotic genome activation to post implantation”的研究論文🚙。在這項研究中,作者進一步優化了mTBLCs培養條件💹,並開發了mTBLCs自發分化和單細胞起始的類囊胚形成系統,mTBLCs-類囊胚具有EPI、PrE和TE譜系,並能進一步形成著床後階段的卵圓柱胚樣結構,重現了從ZGA至囊胚形成的完整發育過程。這一突破為研究全能性👆🏼、細胞命運決定以及早期胚胎形態發生提供了新的技術平臺🐡,也為早期發育的基礎與轉化研究開辟了新的可能性。

論文截圖
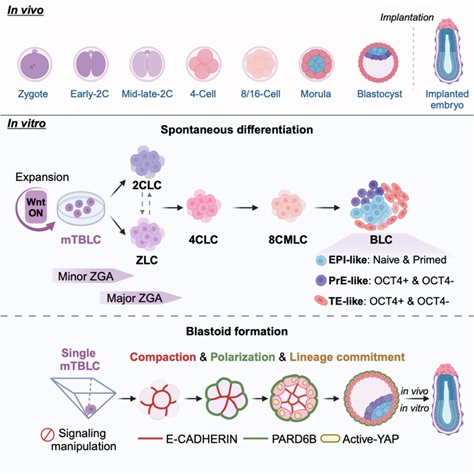
圖1. 通過mTBLCs模擬小鼠早期胚胎發育的關鍵事件的模式圖
在本研究工作中🚓,作者主要有以下發現🤒:
1:該研究通過優化培養基(2MYCP),顯著提高了mTBLCs的增殖速度和長期自我更新能力,主要通過加入2-DG、Minocycline、Y-27632、CHIR-99021和PlaB等因子。在此過程中,PlaB發揮了關鍵作用🤌🏼,通過抑製剪接驅動了從多能性向全能性的轉變📨,而Oct4 基因的去除並未影響mTBLCs在2MYCP培養基中的自我更新能力,表明 Oct4不是維持細胞全能性的必要條件。2MYCP培養基中,Wnt信號通路在mTBLCs中被激活🕰📨,且Wnt信號通路與細胞周期、增殖通路的激活與mTBLCs的快速自我更新能力密切相關🧖🏽♂️。進一步的實驗結果表明,抑製Wnt信號通路可顯著抑製mTBLCs的增殖‼️,證明Wnt信號對於2MYCP培養基中mTBLCs的快速擴增至關重要🤸🏼♀️,但它並不參與維持mTBLCs的全能性。

圖2. Wnt信號的激活促進了mTBLCs的快速擴增
2. mTBLCs具有獨特的表觀基因組特征,這些特征有助於其全能性維持和快速自我更新。通過ATAC-seq和CUT&Tag分析,發現mTBLCs的啟動子區域(TSS)H3K27me3和H3K9me3整體水平下降,而H3K4me3、H3K27ac和RNA Pol II標記整體水平未發生顯著變化⚅,其表觀特征與早期胚胎的初期胚胎細胞(如2細胞階段)相似。此外👨👩👦👦🫠,mTBLCs具有比PSCs更多的寬的H3K4me3域 (broad domain)🎦,以及更少的二價修飾基因(bivalent gene),且MERVL轉座子在mTBLCs中具有顯著的H3K4me3標記🎟。Wnt信號通路的激活進一步增強了與細胞周期和增殖相關基因的H3K4me3富集👵🏿🙂↔️,從而促進了mTBLCs的快速增殖♎️。

圖3. mTBLCs具有類似早期卵裂球的特定表觀特征
3.本研究進一步評估了mTBLCs在體內外的分化潛力。在嵌合體實驗中,通過單細胞數據,捕獲到了EGFP標記的mTBLCs生成的13種細胞,其中包括7個胚外譜系和6個胚內譜系,證明了其在嵌合小鼠中的雙向發育潛能🧏🏽♂️。此外,mTBLCs通過類胚體(EBs)和畸胎瘤實驗也都展示出了胚內外雙向分化潛能,產生了包括神經、心臟和腎臟等三胚層來源的細胞🙉,也激活了包括經典滋養層標誌基因,展示其能夠生成胚外滋養層樣譜系🥐。總體而言,mTBLCs具有強大的雙向發育潛力,能夠分化為各種胚內外譜系🌧,成為評估全能幹細胞發育潛力的重要工具。

圖4. mTBLCs具有強大的胚內外雙向分化潛能
4.本研究利用mTBLCs建立了一個模擬胚胎著床前發育的體外分化模型🕵🏼,以克服現有體外分化系統的挑戰。在基礎分化培養基中培養mTBLCs約3—4天後,細胞形態發生顯著變化,形成了胚胎幹細胞(ESC)🤹🏻♂️、胚外內胚層幹細胞(XEN)和滋養層幹細胞(TSC)樣的克隆🤩。RNA-seq分析顯示,mTBLCs在分化過程中激活了不同發育階段的基因,經歷了從早期初級基因組激活(minor ZGA)到主要基因激活(major ZGA)的轉變。免疫組化驗證了mTBLCs能夠分化為上胚層(EPI)🤯、胚外滋養層(TE)和原始內胚層(PrE)等譜系。單細胞RNA測序揭示🐦🔥,mTBLCs在分化過程中產生了涵蓋2細胞、4細胞🏄🏼、8細胞及囊胚階段的多種細胞類型,擬時間分析顯示mTBLCs經歷了兩次命運決定,首次產生TE樣細胞和ICM/EPI樣細胞,隨後ICM/EPI樣細胞分化產生了PrE樣細胞🕵🏽♀️。
研究進一步發現,在自發分化過程中,mTBLCs還產生了Zscan4+ 和Zscan4-兩類基因組激活樣細胞(ZLCs)。擬時間分析表明,只有Zscan4- ZLCs能夠分化為EPI🪠、PrE和TE三大譜系👨🏽🔬。因此🚙,本研究提出,主要的ZGA調控網絡可能至少可以分為由Zscan4表達標記的兩個獨立部分🧑。同時,Zscan4的表達可能並不是進一步幹細胞命運決定所必需的📨🧴。這一觀察結果也與人類TBLC的自發分化過程一致🔞,在這一過程中👱🏽,經典的ZGA標誌基因(如ZSCAN4/5A、DUXA/B和TPRX1等)完全沒有被誘導表達(Li et al., 2024)👱🏽♂️。這些發現不僅進一步證實了 mTBLCs的內在全能性📤,也為探索哺乳動物胚胎發育過程中的共性機製提供了新視角。

圖5. mTBLCs自由分化體系模擬著床前胚胎發育
5. 此外👩🏻🔬,本研究發現,在沒有任何外源性信號幹預的情況下,單個mTBLC能夠經歷擴增、極化和壓實過程,最終高效率的形成結構完整的類囊胚(blastoid)。這一類囊胚結構不僅包含內細胞團、原始內胚層和滋養外胚層等胚胎樣細胞,且未見異常中間狀態的細胞,mTBLC來源的囊胚在轉錄組上與體內囊胚更為接近🧑💻,三個譜系的特定標誌物富集👨🦽➡️。並且類囊胚可以在體外繼續培養🤏🏿,發育成類似卵圓柱的後植入階段結構⇨。也可以將類囊胚移植到假孕小鼠中,其成功植入並形成卵圓柱樣著床後胚胎結構🐋。

圖6. mTBLCs生成類囊胚並進一步發育成著床後卵圓柱樣胚胎
綜上👨🏻🍼,本研究首次建立了基於mTBLC的自發分化和胚胎樣結構形成系統,成功模擬了胚胎早期發育的多個關鍵環節。尤其是在細胞命運決定和全能性研究領域,這一系統為理解早期胚胎發育中的細胞命運轉變提供了新的視角🐗。此外,該研究還為胚胎發育模型的應用開辟了新的可能性☝️🎛,未來基於這一系統,科學家們有望深入研究胚胎發育異常的分子機製🪁🧑🏼⚕️,探索病理過程,甚至為解決不孕不育等生育醫學問題提供全新解決方案。
杜鵬為該論文的通訊作者。意昂3体育官网生命科學學院博士後彭冰🏩、意昂3体育官网前沿交叉學科研究院博士研究生王清儀、生命科學學院博士研究生張飛翔為本文的並列第一作者。意昂3体育官网生命科學學院博士後申輝參與了部分工作。該項工作得到了北京高等學校卓越青年科學家計劃、北京市自然科學基金、國家自然科學基金🥩、國家重點研發計劃基金的支持。
參考文獻
Li, S., Yang, M., Shen, H., Ding, L., Lyu, X., Lin, K., Ong, J., and Du, P. (2024). Capturing totipotency in human cells through spliceosomal repression. Cell 187 , 3284-3302.e23. https://doi.org/10.1016/j.cell.2024.05.010.
Shen, H., Yang, M., Li, S., Zhang, J., Peng, B., Wang, C., Chang, Z., Ong, J., and Du, P. (2021). Mouse totipotent stem cells captured and maintained through spliceosomal repression. Cell https://doi.org/10.1016/j.cell.2021.04.020.
轉載本網文章請註明出處