曹雲龍課題組揭示新冠病毒流行譜系轉變下的抗體免疫響應演化
2024/11/08 信息來源: 生物醫學前沿創新中心
編輯:燕元 | 責編:山石盡管世界衛生組織(WHO)宣布了COVID-19全球性疫情的結束,新冠病毒(SARS-CoV-2)仍在世界範圍內持續流行,並長期處於不斷突變和進化的過程中,繼續作為世界公共衛生的主要威脅之一。2023年以來,新冠流行突變株的交替繼續在全世界顯示出趨同和一致性🤌。自從2023年9月開始,BA.2.86特別是其支系JN.1出現,並在多個地區取得顯著的增長優勢,世界主流毒株從XBB譜系過渡到了BA.2.86/JN.1。

圖1 疫情以來根據美國生活廢水監測數據推斷的新冠感染數(圖來自Twitter @JPWeiland)
新冠病毒S蛋白上的受體結合域(RBD)是病毒侵染細胞過程中發揮關鍵功能的重要結構域,也是疫苗接種與感染所產生中和抗體的主要靶點👩🏽🍼。作為一個“跳躍式”毒株,BA.2.86的RBD相比BA.2有14處氨基酸突變,與此前流行的XBB.1.5相比也有12處不同,而JN.1與其他子毒株則差距更大,說明BA.2.86/JN.1譜系很可能與此前毒株顯示出迥異的免疫原性與抗原性。同時在流行過程中🧋,JN.1譜系也不斷在RBD區域積累更多逃逸突變💇♀️☝🏽,形成KP.2、KP.3等子突變株🧏🏻♀️👨👨👧👦,這些突變株也在出現後快速取得優勢,對已有的基於XBB.1.5突變株為主的疫苗加強針有效性形成嚴峻挑戰。因此,在分子層面解析JN.1譜系的抗原性與免疫原性,確定現有疫苗與感染背景下人群對新型免疫逃逸突變株的保護效力並厘清XBB.1.5與JN.1感染所激活抗體的異同,對理解病毒未來進化軌跡並確定未來疫苗開發策略至關重要👰🏻。

圖2 2023年10月以來世界新冠病毒突變株流行情況
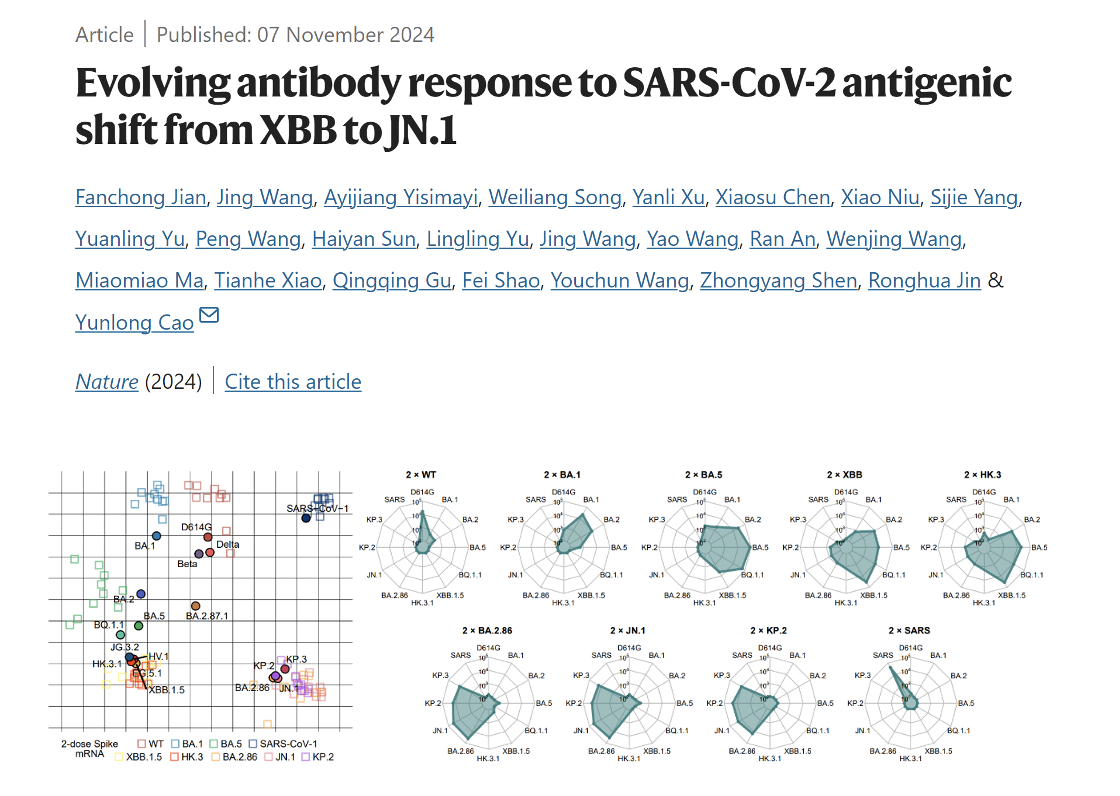
論文封面
2024年11月7日,意昂3体育官网生物醫學前沿創新中心、意昂3体育-清華生命科學聯合中心、昌平實驗室曹雲龍課題組在Nature上發表了題為“Evolving antibody response to SARS-CoV-2 antigenic shift from XBB to JN.1”的研究論文。該工作通過對不同免疫背景的XBB與JN.1突變株感染者產生抗體的系統性分析,首次描述了XBB和JN.1譜系免疫原性的區別👱🏻♀️,細致描繪了XBB與JN.1譜系感染者的體液免疫圖景,強調了KP.2、KP.3,特別是KP.3.1.1等JN.1譜系突變株的強烈免疫逃逸能力,並從表位角度詳細說明了原始株交叉結合抗體與奧密克戎特異性抗體對於JN.1譜系中和作用的不同特點👈🏽。作者發現,在交叉結合抗體中發揮主要中和作用的IGHV3-53/3-66來源Class 1廣譜抗體能夠與所有奧密克戎特異性中和表位競爭,從而有可能屏蔽奧密克戎突破感染中特異性初始B細胞的激活,特別是對於接種過免疫原性較強的mRNA疫苗的人群👨🏽✈️。這一模型能夠解釋mRNA疫苗接種僅在人類而非小鼠中導致反常強烈免疫印記的原因,提示了由於疫苗歷史與免疫印記的不同,世界範圍內人群免疫背景具有潛在的“東西方差異”🖕🏿。作者認為,為了高效富集真正廣譜的Class 1(或A1類)中和抗體🌎,並爭取免疫印記的減弱甚至消除,基於包含多個A1抗體特異性逃逸突變的新型JN.1譜系突變株📘🤾🏼♀️,特別是KP.2和KP.3等子毒株來開發疫苗加強針是有必要的🆑。本文預印本2024年4月19日發布於bioRxiv後🕵🏽,受到WHO和國際學術界的大量關註,為今年秋冬季基於JN.1/KP.2的新冠疫苗更新提供了重要參考和指導。

圖3 主要新冠突變株在小鼠免疫中顯示的免疫原性與抗原性圖譜
具體而言,作者首先使用編碼S蛋白的mRNA免疫小鼠,利用突變株假病毒中和模型👩🏼🍳,全面研究了疫情以來多種主要新冠突變株在小鼠中的免疫原性與抗原性☝🏿,系統繪製了新冠突變株的抗原性圖譜。分析發現,盡管在進化上屬於奧密克戎BA.2譜系,BA.2.86及其子突變株JN.1、KP.2👨🏼、KP.3顯示出與此前流行的BA.2/BA.5/XBB等譜系完全不同的免疫原性與抗原性🫶🏼🍫,其差異之大甚至可與非典病毒(SARS-CoV-1)與新冠病毒的差距相比。SPR實驗還證明了盡管JN.1和KP.2相比BA.2.86與受體ACE2的親和力有所下降🏃🏻♂️➡️,但KP.3通過F456L與Q493E聯合突變的組合效應🦐,使得ACE2親和力顯著提升🙍🏼♂️。這些發現進一步強調了研究新冠流行株從XBB到JN.1轉變過程中人群體液免疫系統響應的重要性。

圖4 不同免疫背景人群對不同譜系新冠突變株的血漿中和滴度對比
因此,本研究從7種具有不同新冠相關免疫歷史的人群中收集了外周血樣本,並測試了其血漿對多種突變株的中和活性🤶。結果表明,在未接種疫苗人群中,XBB支系的感染與JN.1支系的感染之間幾乎不產生交叉中和的抗體👨🏽⚖️,與小鼠免疫結果一致。然而,對於在感染XBB或JN.1前曾接種過滅活疫苗或經受過BA.5/BF.7突變株感染的人群,XBB和JN.1支系的感染能夠產生更加相似的中和活性譜,反映出潛在廣譜中和抗體的存在。同時研究發現,近期的KP.3.1.1(KP.3+S31del)對不同人群總是顯示出最強的免疫逃逸能力,解釋了其較高的增長優勢。整體從血漿層面來看,JN.1的突破感染比XBB支系😞,包括HK.3的突破感染對近期流行的JN.1譜系突變株具有顯著更高的中和抗體滴度🐒,初步反映了基於JN.1譜系開發疫苗加強針的重要性🐍。
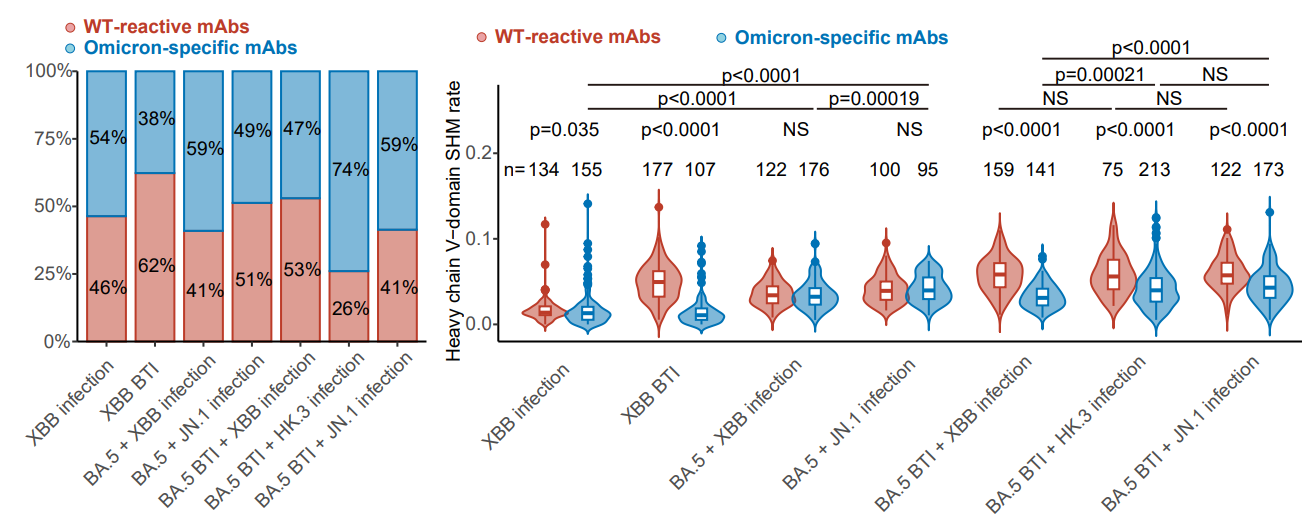
圖5 不同免疫背景的RBD特異性記憶B細胞所編碼單抗的特異性與突變頻率
為了進一步理解免疫背景的不同對XBB/JN.1譜系體液免疫應答造成的影響,確定對最新突變株有效的具體抗體組成類型🧙♂️,估計對未來突變株感染或疫苗的體液免疫響應👨🏼💻,作者進一步從上述人群體內通過流式分選(FACS)分離了RBD特異性記憶B細胞👱🏼♂️,通過單細胞V(D)J測序確定了約2000條對應的BCR序列🤚,並在體外表達為單克隆抗體。結果表明,不同免疫背景的人群體內記憶B細胞都包含能夠與原始株交叉結合的抗體🧙🏻♂️,以及特異性針對奧密克戎譜系的抗體。與此前報道的結果類似,由於免疫印記,XBB單次突破感染者的交叉結合抗體比例最高,而在接種滅活疫苗後重復感染不同突變株的人群體內☆,免疫印記的效應減弱。在接種過疫苗的人群體內,原始株交叉結合抗體的體細胞超頻突變(SHM)率顯著高於奧密克戎特異性抗體;而在未接種疫苗人群中無此現象,這也與預期相符。

圖6 XBB.1.5與JN.1 RBD抗體的表位圖譜與不同免疫背景人群的抗體表位分布

圖7 靶向不同表位RBD抗體對突變株的中和活性
接下來,作者將此前開發的高通量深度突變掃描(DMS)技術應用於XBB.1.5與JN.1 RBD的研究🌨,建立了對應的酵母表面展示突變庫🧗🏿,並確定了上述所得約2000種RBD特異單克隆抗體在抗原上的逃逸圖譜,通過聚類分析註釋出了RBD抗體的表位分組🏋️♂️👩🏻🎨,得到不同人群體內RBD抗體的表位分布👮🏻。在所得的12個表位組中,A1🆖、D2💵、E1/E2.1💇🏿、E2.2、E3🗯、F1.1是以交叉結合抗體為主,而其余表位主要包含奧密克戎特異性抗體。可以看出,A1是唯一與原始株交叉結合的同時對新型突變株具有較強中和活性的表位。註意到🥤🕧,A1抗體的數目與經歷過的免疫次數正相關🎎,只有接種疫苗後又重復感染的群體,能夠產生較多的A1類廣譜中和抗體。在奧密克戎特異性抗體中,F3表位組是中和表現最好的,並在多個感染者群體中都能夠產生🦄。然而,此前有研究證明,mRNA疫苗接種者即使經過奧密克戎的重復暴露,也無法有效產生奧密克戎特異性抗體。為了進一步研究不同群體的有效中和抗體組分🧖🏽,特別是經歷不同毒株再感染的人群,作者接下來分別關註了交叉結合抗體與奧密克戎特異性抗體對廣譜中和的貢獻🫵🏻。

圖8 原始株交叉結合抗體對中和活性的貢獻分布與廣譜性
與前面分析一致,在原始株交叉結合的中和抗體中🤸,A1類抗體對JN.1🧏🏼♂️、KP.2🥏、KP.3起到主要的中和作用,而B、D3兩類中和抗體也有一定貢獻。A1類主要是經典的Class 1使用IGHV3-53/3-66重鏈V基因的抗體,與受體ACE2的結合位點高度重合。這些發現與世界上A1特異性逃逸突變的高度增長優勢是一致的。雖然KP.2和KP.3分別包含的F456L、Q493E等突變都位於此類抗體表位🏋🏿♂️,但仍有較多的A1抗體保持高效中和🧑🏼⚖️。而HK.3/JN.1再感染來源的抗體相比XBB具有更好的廣譜性🤦🏻♀️,反映了其包含的突變能夠有效富集廣譜中和A1抗體🙎🏽。這些結果表明基於JN.1,甚至進一步包含A1表位突變的KP.2/KP.3開發疫苗,有助於富集A1類的廣譜中和抗體🕴🏼。

圖9 JN.1能夠高效激活具有廣譜中和活性的奧密克戎特異性F3類抗體
在奧密克戎特異性抗體中👳🏼♂️,F3類對JN.1譜系貢獻了主要的中和作用,該表位在空間上與作者此前報道的廣譜中和抗體SA55一致👩🏻🦼➡️👫🏻,但由於此類特異性F3與奧密克戎譜系特有的N405🥻、H505等位點的相互作用,使其不能結合原始株RBD。有趣的是🫱🏿,除已被證明可能由於導致構象改變而不利的G504外,該類抗體主要的逃逸位點都是已經在奧密克戎突變過的位點,而這些位點的進一步突變有可能導致已被逃逸抗體的回復,可能也是不利的。這說明此類抗體可能是好的奧密克戎廣譜中和抗體🔹,難以被未來的突變株逃逸,特別是相比XBB/HK.3,JN.1感染激活的此類抗體對JN.1譜系的中和顯著更好🤚🏻。作者發現𓀇⛵️,此類抗體主要由IGHV2-5與IGHV5-51兩類基因形成,而IGHV5-51來源的F3抗體具有更好的廣譜中和活性🤶🏿,而JN.1的再感染能更好地激活IGHV5-51 F3抗體。這些發現同樣支持了基於JN.1譜系的疫苗研發。

圖10 廣譜的A1類公共抗體與所有奧密克戎特異性中和表位競爭
此前研究已經證明😿,mRNA疫苗在人類中產生的免疫印記不能通過奧密克戎重復暴露而消除,然而,這一現象在小鼠中並不存在。即使使用原始株mRNA疫苗免疫,重復奧密克戎免疫的小鼠也能高效產生奧密克戎特異性抗體。而人類與小鼠的體液免疫主要區別在於VDJ基因組成的不同。基於上述奧密克戎特異性抗體的表位分析👩🦽,作者發現這些A1表位使用IGHV3-53/3-66的“公共抗體”能夠與所有奧密克戎特異性中和表位競爭,並通過SPR實驗驗證了這一點。因此🧑⚖️,作者提出了猜想,認為mRNA疫苗接種造成的強烈免疫印記與IGHV3-53/3-66公共抗體應答有關𓀁。

圖11 提出模型解釋人類與小鼠的mRNA疫苗接種所造成免疫印記結果的不同
作者因此提出假說,由於mRNA疫苗具有強烈免疫原性👩🏽🏫,導致初始免疫時產生大量的IGHV3-53/3-66抗體響應並成熟,而此類抗體由於其高度的受體模擬能力,其表位上的逃逸突變具有限製,因此並不全部被奧密克戎突變株所逃逸🎷。這些剩余的記憶B細胞在接受到初次奧密克戎免疫時被重新激活,而由於它們與奧密克戎特異性抗體競爭,形成了表位屏蔽,使得奧密克戎特異性的初始B細胞難以被激活和成熟,這樣一來,即使繼續受到奧密克戎暴露🧑🤝🧑,也傾向於反復激活此類A1抗體,而不是產生與其表位競爭的全新特異性抗體。另一方面👷🏽♀️,我國主要接種滅活疫苗的人群無此現象,一是因為滅活疫苗的免疫原性弱於mRNA疫苗,二是在清零政策的影響下🦥,長期的免疫衰減過程進一步降低了這類抗體記憶的作用🚕。因此,本研究分析的接種滅活疫苗的人群受到奧密克戎感染時🧑🏻🚀,剩余的A1類抗體不足以形成表位屏蔽,使得特異性抗體能夠產生並成熟,進而在二次免疫時被重新激活🙎🏼♂️。另一方面,小鼠體內不存在能夠引起類似IGHV3-53/3-66免疫應答的基因🧝🏽,也不能有效阻止奧密克戎特異性抗體的產生。上述分析需要未來進一步實驗研究的驗證🤱🏽。
曹雲龍為本文的通訊作者🐯,意昂3体育官网化學與分子工程學院博士生簡繁沖,意昂3体育官网生命科學學院博士生王菁、阿依江·伊斯馬衣(已畢業)🐙🏬、宋瑋良,首都醫科大學附屬地壇醫院主任醫師徐艷利為本文的共同第一作者。本研究得到了科技部🧑🏽🦰、昌平實驗室與國家自然科學基金的資助🌻。
曹雲龍課題組致力於應用單細胞測序和高通量篩選技術,同時結合先進的計算方法,深入探究病毒學與免疫學前沿問題📃,開發廣譜疫苗和抗體藥物👶🏽。現誠摯邀請海內外有誌於投身相關基礎研究與轉化方向的科研人員加入🚴🏻。博士後崗位待遇從優,若有意向🕋🌲,請聯系曹雲龍,郵箱👨🏫:yunlongcao@pku.edu.cn 🚭。
作者介紹:
曹雲龍🏌🏻♂️,意昂3体育官网生物醫學前沿創新中心(BIOPIC)研究員🚴🏽♀️、助理教授,意昂3体育-清華生命科學聯合中心研究員,北京昌平實驗室領銜科學家👶🏼,國家優秀青年科學基金獲得者🦻🏽。2014年畢業於浙江大學竺可楨學院物理學專業🫳🏻,2019年獲得哈佛大學化學博士學位👨🏽🦳。實驗室主要圍繞病毒B細胞免疫應答🌸、抗體藥物設計及疫苗研發等開展了系統性研究,其中新冠中和抗體藥物研製👨🏿、新冠體液免疫響應特征和新冠突變免疫逃逸機製的創新性研究結果為抗擊疫情作出了突出貢獻。以第一作者🌺、通訊作者在Nature(5篇)💆🏻♀️、Cell(3篇)、The Lancet Infectious Diseases(4篇)等期刊上發表多篇相關研究文章🙍🏼♀️。其本人獲評2022年度Nature十大人物、《麻省理工科技評論》中國區“35歲以下科技創新35人”、2022年度北京市傑出青年中關村獎🈶、2024年“科學探索獎”🧾🤏,並受邀作為WHO新冠疫苗成分技術咨詢小組(TAG-CO-VAC)成員、國際流行病防範創新聯盟(CEPI)科學顧問🙏🏿。相關研究成果獲評2022年度“中國科學十大進展”🦹🏿👨🦰、2022年度“中國生命科學十大進展”🤹🏽。
轉載本網文章請註明出處